INTERACCIONES ENTRE LA LUZ Y LA MATERIA.
La identificación de cualquier sustancia exige la determinación de su formula química mediante análisis químico elemental que se lleva a cabo utilizando técnicas espectrométricas.
La espectroscopia es una técnica de análisis, basada en la interacción de la luz con la materia, que proporciona información cualitativa y cuantitativa, de una sustancia objeto de estudio.

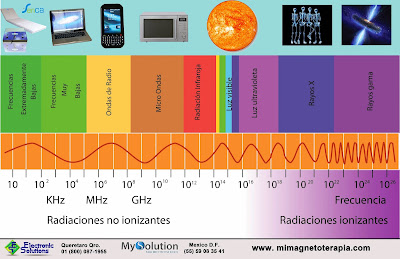
NATURALEZA ELECTROMAGNÉTICA DE LA LUZ.
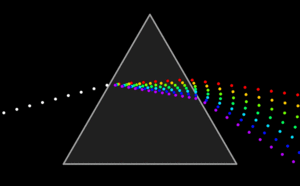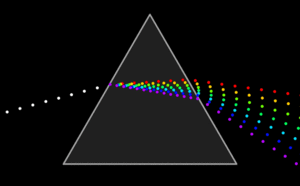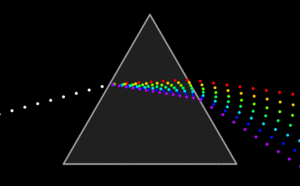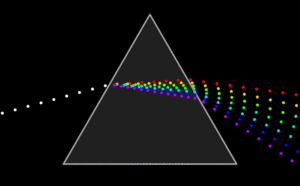
Herschel descubrió, al descomponer la luz solar, que más allá del rojo había una luz invisible al ojo humano, pero detectable por su calor, la luz infrarroja, IR.
Ritter encontró otra radiación solar invisible más allá de la violeta; no generaba calor, pero ennegrecía el cloruro de plata. Era la luz ultravioleta, UV.
Maxwell y Hertz demostraron que las ondas luminosas no son ondas materiales, sino electromagnéticas. Su estudio permitió descubrir otro tipo de radiaciones electromagnéticas no visibles: las microondas, los rayos X, y los rayos gamma.
Si ordenamos todos estos tipos de lunes, obtenemos el espectro de la radiación electromagnética.
La frecuencia de una onda, f, es el número de oscilaciones o ciclos que dicha onda realiza por unidad de tiempo en el medio por el que se propaga.
La unidad de frecuencia en el SI es el ciclo/s, que recibe el nombre de hercio (Hz). F=1/T.
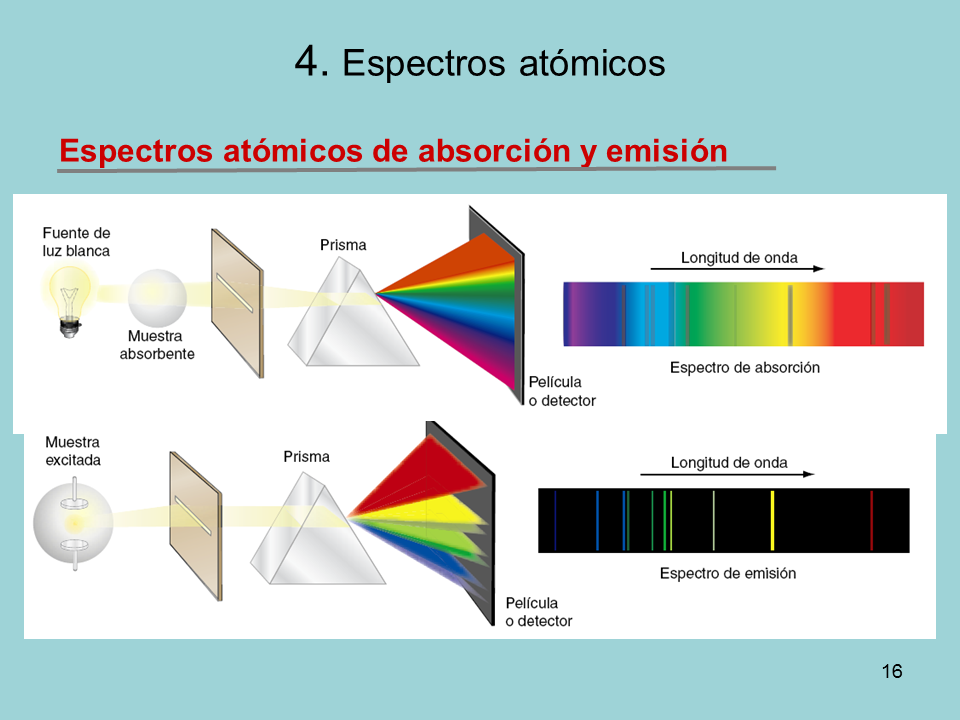
ESPECTROSCOPIA ATÓMICA.
Los átomos aislados pueden emitir y absorber radiación electromagnética. La física clásica no explica bien este proceso; lo hace la teoría cuántica. Cuando los átomos son excitados con una fuente de energía externa emiten luz. Al descomponer y analizar esa luz se obtiene un espectro de emisión atómica. Si se ilumina una muestra y se analiza el espectro de la luz que ha atravesado los átomos, se obtiene un espectro de absorción atómica. Los espectros atómicos son discontinuos, porque no contienen todas las frecuencias, sino solo algunas. A cada frecuencia le corresponde e el espectro una fina raya llamada línea. Las de emisión son brillantes sobre fondo negro, y las de absorción son negras sobre fondo luminoso. La posición y la anchura de las líneas identifican al elemento químico, son como su huella dactilar.


No hay comentarios:
Publicar un comentario